اسید ها و باز ها در شیمی ترکیبات بسیار متنوعی هستند و برای شناسایی آنها از چندین نظریه استفاده میشود. در آخرین نظریه قابل قبول در مورد اسید ها و باز ها آنها را بهصورت گونههای پذیرنده و گیرنده الکترون از یکدیگر در نظر میگیرند. این دسته از ترکیبات کاربرد فراوانی دارند و در بسیاری از واکنشهای شیمیایی و ترکیبات مورد استفاده در زندگی روزمره از آنها استفاده میکنیم. به دلیل اهمیت و گستردگی فراوان این ترکیبات، آشنایی با آن برای تمامی دانشجویان رشته شیمی و رشتههای مرتبط دیگر واجب است و به آنها در انجام آسانتر و درک بهتر واکنشهای شیمیایی کمک میکند. در این مطلب از مجله فرادرس میخواهیم با انواع اسید ها و باز ها در شیمی آشنا شویم و ابتدا نظریههایی که پیرامون آنها وجود دارد را بررسی خواهیم کرد. سپس به معرفی اسید ها و بازها قوی و ضعیف میپردازیم و در هر دسته تعدادی را به عنوان مثال مطرح میکنیم. در ادامه بر مفهوم اسید و باز مزدوج و نحوه شناسایی آنها در واکنشهای شیمیایی مروری خواهیم داشت. در بخش بعد به ثابت تعادل اسید ها و باز ها میپردازیم که از جمله مهمترین موارد مورد نیاز برای انجام محاسبات در این مبحث است.
همچنین در ادامه با واکنش خنثی شدن آشنا میشویم که در آن اسید ها و باز ها تبدیل به ترکیباتی خنثی به نام نمک میشوند. تیتراسیون اسید ها و باز ها از دیگر مواردی است که با آن آشنایی پیدا میکنیم و در ادامه انواع واکنشهای که این ترکیبات انجام میدهند را معرفی میکنیم. در نهایت به ویژگیهای این دسته از ترکیبات شیمیایی میپردازیم و برای محک آموختههای خود چند مثال و تمرین را بررسی خواهیم کرد.
اسید ها و باز ها
اسید ها و باز ها یکی از رایجترین ترکیبات شیمیایی مهستند که در شیمی و در زندگی روزانه با آنها روبرو میشویم. آنها به دلیل ویژگیهای متفاوتی که از خود نشان میدهند، شناختهشده هستند.
در حالی که محلول اسیدها طعمی ترش دارد، بازها تلخ هستند و در تماس با پوست حالت صابونی و لغزندهای ایجاد میکنند. این دسته از ترکیبات با بسیاری از گونههای شیمیایی وارد واکنش میشوند و نمکها را به وجود میآورند.
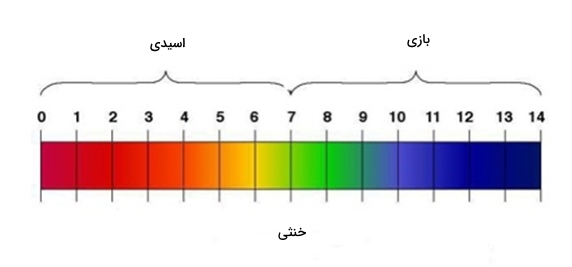
اسیدها رنگ کاغذ شناساگر اسید و باز لیتموس را به قرمز در میآورند در حالی که این کاغذ در مجاورت بازها رنگی آبی پیدا میکند. توجه داشته باشید که مقدار $$pH$$ آنها نیز متفاوت است، بهصورتی که برای اسیدها از ۰ تا ۷ و برای بازها از ۷ تا ۱۴ خواهد بود و این را در تصویر بالا مشاهده میکنید.
نظریه اسید ها و باز ها
در طول تاریخ دانشمندان برای معرفی اسیدها و آسانی تشخیص و کاربرد از آنها از نظریههای متعددی استفاده کردهاند که باید با آنها آشنایی داشته باشیم و در ادامه به مرور آنها خواهیم پرداخت.
در فهرست زیر سه نظریه را مشاهده میکنید که مهمترین نظریههای موجود پیرامون اسید ها و بازها هستند.
- نظریه اسید ها و باز ها آرنیوس (sArrhenius Acids and Base)
- نظریه اسید ها و باز ها برونستند لوری (Bronsted Lowry Acids and Bases)
- نظریه اسید ها و باز ها لوییس (Lewis Acids and Bases)
نظریه اسید ها و باز ها آرنیوس چیست؟
نظریه اسید ها و باز ها آرنیوس در سال ۱۸۳۴ میلادی توسط شیمیدان سوئدی «سوانتیه آرنیوس» (Svante Arrhenius) ارائه شد که در آن ویژگی اسیدی بودن را به یون هیدرونیوم با فرمول شیمیایی $$H^+$$ مرتبط دانست. طبق این نظریه اسید آرنیوس مادهای است که با اضافه شدن به آب، باعث افزایش غلظت $$H^+$$ در آن میشود.
نکتهای که باید به آن توجه داشته باشیم این است که یون $$H^+$$ به این صورت در آب وجود ندارد و برای سهولت در واکنشهای اسید ها و باز ها از آن استفاده میشود. در واقع این یون بهصورت هیدراته است و با فرمول شیمیایی $$H_3O^+$$ نشان داده میشود و یون هیدروکسونیوم نام دارد. بنابراین میتوان اینطور بیان کرد که اسید آرنیوس گونهای شیمیایی است که با اضافه شدن به محیط آبی، باعث افزایش مقدار یون هیدروکسونیوم در آن میشود.
نظریه اسید ها و باز ها آرنیوس از تعادل تفکیک آب و تبدیل آن به یونهای هیدرونیوم و هیدروکسید ناشی میشود که میتوانید آن را در زیر مشاهده کنید.
$$ {H_2O(l) + H_2O(l) rightleftharpoons H_3O^{+}(aq) + OH^{-}(aq)} nonumber $$
همچنین میتوان از رابطه زیر برای به دست آوردن حصلضرب یونی آب $$(K_w)$$ استفاده کرد.
$$ K_w={[H^{+}][OH^{-}]} $$
مقدار حاصلضرب یونی آب با تغییر دما دستخوش تغییر میشود و مقادیر متفاوتی را به دست میدهد. در آب خالص بیشتر مولکولهای آب بهصورت $$H_2O$$ حضور دارند اما این مولکولها دائما تفکیک میشوند و دوباره به حالت اولیه خود در میآيند بهصورتی که در هر زمان تعداد کمی از مولکولها ( ۱عدد به ازار $$10^7$$ مولکول) به شکل یون هیدرونیوم و هیدروکسید حضور دارند و تعداد آنها نیز با یکدیگر برابر خواهد بود. به دلیل وجود این دو یون با مقادیر یکسان، آب در حالت خالص خود خنثی است.
همچنین در این نظریه گونه شیمیایی باز در نظر گرفته میشود که در فرآیند حل شدن در آب، باعث افزایش غلظت یون هیدروکسید شود. میدانیم که با افزایش غلظت یون هیدروکسید از غلظت یون هیدرونیوم کاسته میشود. بنابراین طبق نظریه آرنیوس اسید مادهای است که در انحلال در آب باعث افزایش در غلظت یون هیدرونیوم یا کاهش در غلظت یون هیدروکسید میشود.
به معادله زیر توجه کنید که به خوبی به رابطه اسید و باز و کاهش و افزایش هر کدام طی واکنش شیمیایی اشاره میکند. در این معادله در سمت چپ اسید و باز و در سمت راست اسید مزدوج و باز مزدوج وجود دارد.
$$ text{acid} + text{base} ⇌ text{conjugate base} + text{conjugate acid}. nonumber $$
در صورتی که اسیدی دارای فرمول شیمیایی $$HA$$ و بازی دارای فرمول شیمیایی $$B$$ باشد، میتوان واکنش بالا را برای آن به این شکل نوشت.
$$ HA + B rightleftharpoons A^{-} + HB^{+} nonumber $$
همانطور که مشاهده میکنید برای نشان دادن این واکنش از فلش دوطرفه استفاده میشود زیرا واکنش میتواند در مسیر برعکس نیز پیشروی کند. اسید $$HA$$ با از دست دادن یک یون هیدروژن به باز مزدوج خود با فرمول شیمیایی $$A^-$$ تبدیل میشود.
همچنین باز $$B$$ میتواند یون هیدروژن به دست آورد و تبدیل به اسید مزدوج خود با فرمول شیمیایی $$HB^+$$ شود. بیشتر واکنشهای اسید ها و باز ها سریع هستند و به همین دلیل جزای دخیل در این واکنشها با یکدیگر در تعادلی دینامیکی هستند.
نظریه اسید ها و باز ها برونستند لوری چیست؟
در بخش قبلی با نظریه اسید ها و باز ها آرنیوس آشنا شدیم. با وجود این که میتوان از این نظریه برای توصیف بسیاری از واکنشها استفاده کرد اما محدودیتهایی دارد که نیاز به نظریههای دیگر را به وجود میآورد.
در سال ۱۹۲۳ میلادی، دو دانشمند به نامهای «یوهانس نیکولاس برونستد» (Johannes Nicolaus Bronsted) و «توماس مارتین لوری» (Thomas Martin Lowry) بهصورت جداگانه به این جمعبندی رسیدند که در واکنش اسید ها و باز ها با انتقال یون هیدرونیوم مواجه هستیم.

طبق این نظریه، گونهای اسید برونستند لوری است که بتواند به باز برونستد لوری یون هیدرونیوم اهدا کند. این نظریه نسبت به نظریه آرنیوس مزیتهای زیادی دارد.

برای مثال به دو واکنش زیر توجه کنید که در هر دو استیک اسید حضور دارد.
$$ {CH_3COOH + H_2O rightleftharpoons CH_3COO^{-} + H_3O^{+}} nonumber $$
$$ {CH_3COOH + NH_3 ⇌ CH_3COO^{-} + NH_4^{+}} nonumber $$
از هر دو نظریه آرنیوس و برونستد لوری میتوان برای توجیه واکنش اول استفاده کرد. طبق نظریه آرنیوس $$CH_3COOH$$ نقش اسید را ایفا میکند زیرا در واکنش یون هیدروکسونیوم را به وجود میآورد. همچنین طبقه نظریه برونستد لوری اسید به دلیل اهدای یون هیدرونیوم به آب، اسید به شمار میرود.
در مثال دوم استیک اسید واکنش مشابهی را انجام میدهد و به آمونیاک یک یون هیدرونیوم اهدا میکند اما نمیتوان برای توجیه آن از نظریه آرنیوس استفاده کرد زیرا طی آن یون هیدرونیوم تولید نمیشود. بنابراین میتوان این نظریه را اینطور جمعبندی کرد که اسید برونستد لوری گونهای است که بهصورت مستقیم با غیرمستقیم پروتون بدهد و باز آن گونهای است که بهصورت مستقیم یا غیرمستقیم پروتون بگیرد.
نظریه اسید ها و باز ها لوییس چیست؟
در این بخش به سومین نظریه موجود پیرامون اسید ها و باز میپردازیم. این نظریه در سال ۱۹۲۳ میلادی توسط دانشمند آمریکایی «گیلبرت نیوتون لوویس» (Gilbert Newton Lewis) معرفی شد که در آن خبری از انتقال یون هیدرونیوم بین اسید ها و باز ها نیست. طبق این نظریه، گونهای اسید است که با باز اسید وارد واکنش میشود و محصول افزایشی را به وجود میآورد.

اسید لوییس گونهای است که از یک گونه دیگر زوج الکترون دریافت میکند، بنابراین میتوان آن را «پذیرنده الکترون» (Electron Acceptor) نامید. واکنش اسید ها و باز ها برونستد لوری شامل انتقال هیدرنیوم است اما در واکنش اسید باز ها لوییس انتقال زوجالکترون انجام میشود. بنابراین تمامی اسیدهای برونستد لوری اسید لوویس هستند اما عکس آن صادق نیست، یعنی تمامی اسیدهای لوییس نمیتوانند اسید برونستد لوری باشند. به دو واکنش زیر توجه کنید.
$$ {BF_3 + F^{-} rightleftharpoons BF_4^{-}} nonumber $$
$$ {NH_3 + H^{+} rightleftharpoons NH_4^{+}} nonumber $$
در واکنش اول گونه $$BF_3$$ یک اسید لوییس است زیرا از یون فلوئورید الکترون دریافت میکند. همانطور که مشاهده میکنید در آن خبری از یون هیدرونیوم نیست بنابراین با نظریه برونستد لوری قابل توصیف و توجیه نخواهد بود.
با این حال برای توصیف واکنش دوم میتوان از هر دو نظریه استفاده کرد. در این واکنش یک یون هیدرونیوم به آمونیاک منتقل میشود. همچنین آمونیاک نقش باز لوییس را نیز ایفا میکند زیرا در آن انتقال الکترون صورت گرفته است. بنابراین میتوان اینطور جمعبندی کرد که اسید لوییس گونه گیرنده الکترون و باز اسید گونه دهنده الکترون است.
اسیدها و باز ها قوی و ضعیف
اسید ها و باز ها با توجه به ویژگیهایی که از خود بروز میدهند به دو نوع ضعیف و قوی طبقهبندی میشوند و شناسایی آنها از اهمیت بهسزایی برخوردار است.
در ادامه میخواهیم به معرفی هر کدام از آنها بپردازیم و تفاوتهایی که دارند را مورد بررسی قرار دهیم.
اسیدهای ضعیف و قوی
برای فهم بهتر تفاوت اسید ضعیف از اسید قوی، هیدروکلریک اسید را در نظر بگیرید. زمانی که این اسید در آب حل میشود، بهطور کامل به یونهای سازنده خود یعنی $$H^+$$ و $$Cl^-$$ تفکیک خواهد شد.

در این صورت هیچ مولکول $$HCl$$ در محیط باقی نمیماند و همه تبدیل به یون میشوند. این واکنش تفکیک را میتوان بهصورت زیر نمایش داد.
$$HCloverset{100%}{rightarrow}H^{+}(aq)+Cl^{-}(aq) nonumber $$
به هر اسیدی که بهصورت کامل و ۱۰۰٪ به یونهای سازنده خود تفکیک شود، «اسید قوی» (Strong Acid) گفته میشود. بنابراین میتوانیم «اسید ضعیف» (Weak Acid) را بهصورت اسیدی تعریف کنیم که بهصورت کامل به یونهای سازنده خود تفکیک نمیشد. در زیر واکنش مربوط به استیک اسید را مشاهده میکنید که با فرمول شیمیایی $$HC_2H_3O_2$$ اسید ضعیفی به شمار میرود.
$$HC_{2}H_{3}O_{2}overset{sim 5%}{longrightarrow}H^{+}(aq)+C_{2}H_{3}O_{2}^{-}(aq) nonumber$$
با توجه به اینکه واکنش بالا بهصورت ۱۰۰٪ پیشرفت ندارد، نوشتن آن به شکل برگشتپذیر مناسبتر است که مانند زیر خواهد بود.
$$ HC_{2}H_{3}O_{2}rightleftharpoons H^{+}(aq)+C_{2}H_{3}O_{2}^{-}(aq) nonumber $$
اسیدهای قوی انگشتشمار هستند و در زیر فهرستی از آنها را مشاهده میکنید.
- $$HCl$$
- $$HBr$$
- $$HI$$
- $$HNO_3$$
- $$H_2SO_4$$
- $$HClO_3$$
- $$HClO_4$$
در صورتی که اسیدی در لیست بالا وجود نداشته باشد، ضعیف است. توجه داشته باشید که یونیزاسیون این اسید ممکن است از ۱٪ تا ۹۹٪ باشد اما همچنین به دلیل کامل نبودن تفکیک، اسید ضعیف خوانده میشود.
بازهای ضعیف و قوی
حال که با تعریف اسید قوی و ضعیف آشنا شدیم، میتوانیم به راحتی تعریفی از بازهای قوی و ضعیف نیز ارائه دهیم. «باز قوی» (Strong Base) بازی است که در محلول بهصورت کامل و ۱۰۰٪ تفکیک شود، در صورتی که تفکیک بازی کمتر از ۱۰۰٪ باشد، آن را به عنوان «باز ضعیف» (Weak Base) میشناسیم. در فهرست زیر به بازهای قوی موجود اشاره کردهایم.
- $$LiOH$$
- $$NaOH$$
- $$KOH$$
- $$RbOH$$
- $$CsOH$$
- $$ Mg(OH)_2 $$
- $$Ca(OH)_2$$
- $$Sr(OH)_2$$
- $$Ba(OH)_2$$
هر بازی که در فهرست بالا نباشد، ضعیف است. همانطور که مشاهده میکنید تمامی بازهای بالا هیدروکسیدی هستند. بنابراین بازی مانند آمونیاک با فرمول شیمیایی $$NH_3$$ که فاقد $$OH$$است، ضعیف به حساب میآید.
اسید و باز مزدوج چیست؟
اسید و باز مزدوج در مطالعه اسیدها مفهوم بسیار مهمی است که باید با آن آشنایی داشته باشیم. ابتدا به واکنش تفکیک اسید $$HA$$ توجه کنید.
$$ HA_{(aq)} rightleftharpoons A^-_{(aq)} + H^+_{(aq)} $$
در این تعادل، باز $$A^-$$ را «باز مزدوج» (Conjugate Base) اسید $$HA$$ مینامیم. همانطور که مشاهده میکنید این باز یک یون هیدرونیوم از اسید خود کمتر دارد. همچنین میتوان تعادل تفکیک باز $$B$$ را بهصورت زیر نمایش داد.
$$ B_{(aq)} + H_2O_{(l)} rightleftharpoons HB^+_{(aq)} + OH^-_{(aq)} $$
در این تعادل گونه $$HB^+$$، «اسید مزدوج» (Conjugate Aicd) باز $$B$$ است. حال مثالی را بررسی میکنیم که پیچیدگی بیشتری دارد و مربوط به واکنش بین آمونیاک و آب است.
$$ NH_3+H_2Orightleftharpoons NH^+_4+OH^− $$
در این واکنش آمونیاک باز است و آمونیوم با فرمول شیمیایی $$NH_4^+$$ اسید مزدوج آن به حساب میآید. همچنین دو گونه $$H_2O$$ و $$OH^-$$ نیز اسید و باز مزدوج یکدیگر هستند.
ثابت تفکیک اسید
در بخش قبلی به تعادل تفکیک اسید و باز اشاره کردیم. از «ثابت تعادل» (Equilibrium Constant) میتوان برای پی بردن به قدرت اسید و باز استفاده کرد که در ادامه به بررسی آن خواهیم پرداخت.
برای مثال اسیدی را در نظر بگیرید که دارای فرمول شیمیایی $$HA$$ است، در این صورت باز مزدوج آن را با $$A^-$$ میتوان نمایش داد که واکنش انحلال آن در آب را در زیر مشاهده میکنید.
$$ HA_{(aq)}+H_2O_{(l)} rightleftharpoons H_3O^+_{(aq)}+A^−_{(aq)}$$
در این صورت مقدار ثابت تفکیک آن را میتوان از رابطه زیر به دست آورد.
$$ K=dfrac{[H_3O^+][A^−]}{[H_2O][HA]} $$
از آنجا که منظور از $$[H_2O]$$ فعالیت آب است و آن نیز به دلیل حلال بودن برابر با ۱ است، میتوان آن را از معادله حذف و سادهسازی کرد. همچنین میتوانیم به جای $$H_3O^+$$ از $$H^+$$ استفاده کنیم که در این صورت واکنش بالا به شکل زیر خواهد بود.
$$ HA_{(aq)} rightleftharpoons H^+_{(aq)}+A^−_{(aq)} $$
میدانیم که یون $$H^+$$ نمیتواند به تنهایی در محلول آبی حضور داشته باشد اما برای سادگی آن را به این صورت نشان میدهیم. هرچه مقدار $$K_a$$ یعنی ثابت تفکیک اسیدی بزرگتر باشد، اسید قویتر است و غلظت یون هیدرونیوم نیز در تعادل بیشتر خواهد بود.

با لگاریتم گرفتن از دو طرف رابطه ثابت تفکیک اسیدی مقدار $$K_a$$ به $$pK_2$$ تبدیل میشود که کار با آن راحتتر است. در زیر به مقدار ثابت تفکیک تعدادی از اسیدهای رایج اشاره کردهایم که با مقایسه آنها میتوان به مقایسه قدرت اسید پرداخت.
| اسید | مقدار $$K_a$$ | مقدار $$pK_a$$ |
| $$HI$$ | $$ 2 times 10^{9} $$ | ۹٫۳- |
| $$HNO_3$$ | $$2.3 times 10^{1} $$ |
۱٫۳۷- |
| $$CH_3COOH$$ | $$ 1.7 times 10^{−5} $$ | ۴٫۷۶ |
| $$C_2H_2$$ | $$ 1 times 10^{−26} $$ | ۲۶ |
| $$HF$$ | $$ 6.3 times 10^{−4} $$ | ۳٫۲ |
همانطور که پیشتر مشاهده کردید، بازهای ضعیف با آب وارد واکنش میشوند و یون هیدروکسید را به وجود میآورند که میتوان آن را بهصورت زیر نمایش داد. در این واکنش $$B$$ باز و $$BH^+$$ اسید مزدوج آن است.
$$ B_{(aq)}+H_2O_{(l)} rightleftharpoons BH^+_{(aq)}+OH^−_{(aq)} label{16.5.4} $$
ثابت تعادل این واکنش را با $$K_b$$ نمایش میدهند و از رابطه زیر به دست میآيد.
$$ K_b= frac{[BH^+][OH^−]}{[B]} label{16.5.5} $$
هرچه مقدار $$K_b$$ بزرگتر باشد، باز مورد نظر قویتر است و مقدار یون هیدروکسید بیشتری در تعادل وجود دارد. در جدول زیر به تعدادی از بازها پرداختهایم.
| باز | مقدار $$K_b$$ | مقدار $$pK_b$$ |
| $$PO_4^{3-}$$ | $$ 2.1 times 10^{−2} $$ | ۱٫۶۸ |
| $$NH_3$$ | $$ 1.8 times 10^{−5} $$ | ۴٫۷۵ |
| $$C_5H_5N$$ | $$ 1.7 times 10^{−9} $$ | ۸٫۷۷ |
رابطه بین قدرت اسید و باز مزدوج
رابطه بین مقدار $$K_a$$ یک اسید و مقدار $$K_b$$ باز مزدوج آن بسیار ساده است. برای روشن شدن این رابطه مثالی را بررسی میکنیم که مربوط به هیدروسیانیک اسید با فرمول شیمیایی $$HCN$$ است. در واکنش اول یونیزاسیون $$HCN$$ را در آب مشاهده میکنید که به تولید محلول اسیدی میانجامد و میتوان آن را بهصورت زیر نشان داد.
$$ HCN_{(aq)} rightleftharpoons H^+_{(aq)}+CN^−_{(aq)} $$
در واکنش زیر نیز $$CN^-$$ با آب وارد واکنش میشود و نتیجه محلولی بازی است.
$$ CN^−_{(aq)}+H_2O_{(l)} rightleftharpoons OH^−_{(aq)}+HCN_{(aq)} $$
همانطور که مشاهده میکنید در واکنش اول اسید و در واکنش دوم باز مزدوج آن حضور دارند. با نوشتن ثابت تعادل برای هر یک از آنها میخواهیم رابطهای که دارند را مورد بررسی قرار دهیم. در زیر معادله مربوط به تفکیک اسید را مشاهده میکنید.
$$ K_a=dfrac{[H^+][CN^−]}{[HCN]} $$
همچنین میتوان برای به دست آوردن ثابت تعادل واکنش دوم از رابطه زیر استفاده کرد.
$$ K_b=dfrac{[OH^−][HCN]}{[CN^−]} $$
در صورتی که این دو واکنش را به یکدیگر اضافه کنیم و گونههای تکراری را از دو طرف خط بزنیم، واکنش زیر به دست میآيد که مربوط به یونیزاسیون آب است.
$$ H_2O_{(l)} rightleftharpoons H^+_{(aq)}+OH^−_{(aq)} $$
رابطه زیر برای یونیزاسیون آب صدق میکند.
$$ K_aK_b = K_w $$
در صورتی که مقدار $$K_a$$ اسید و مقدار $$K_b$$ باز مزدوج را بدانیم میتوانیم مقدار ثابت تعادل را برای آنها به راحتی به دست بیاوریم. همانطور که پیشتر گفتیم میتوانیم برای تبدیل این ثابتها تفکیک که دارای توانهای بزرگی هستند از لگاریتم استفاده کنیم که نتیجه مانند زیر خواهد بود.
$$ pKa = −log_{10}K_a $$
$$ K_a=10^{−pK_a} $$
به همین صورت میتوان مقدار ثابت تفکیک بازی را نیز تبدیل کرد.
$$ pK_b = −log_{10}K_b $$
$$ K_b=10^{−pK_b} $$
بنابراین میتوان رابطه تعادل بالا را به شکل زیر نوشت که در دمای ۲۵ درجه سانتیگراد برابر با ۱۴ خواهد بود.
$$ pK_a + pK_b = pK_w $$
$$ pK_a + pK_b =14 $$
واکنش خنثی شدن اسید ها و باز ها
«واکنش خنثی شدن» (Neutralization Reaction) زمانی صورت میگیرد که یک اسید و یک باز با یکدیگر وارد واکنش شوند و دو محصول آب و نمک را به وجود بیاورند. واکنش خنثی شدن اسید قوی با باز قوی دارای $$pH$$ برابر با ۷ است اما در صورتی که اجزای دخیل در این واکنش اسید قوی و باز ضعیف باشد، مقدار $$pH$$ کمتر ز ۷ خواهد بود.
همچنین واکنش خنثی شدن بین یک اسید ضعیف و باز قوی به تولید $$pH$$ بیشتر از ۷ میانجامد. وقتی محلولی خنثی میشود به این معناست که نمک از مقادیر برابر اسید و باز به دست آمده است. مقدار اسیدی مورد نیاز برابر با مقداری است که میتواند ۱ مول از یون هیدرونیوم به دست دهد. به همین صورت مقدار مورد نیاز برای باز مقداری است که میتواند ۱ مول از یون هیدروکسید به وجود بیاورد.

واکنش خنثی شدن اسید قوی و باز قوی
گفتیم که واکنش خنثی شدن بین اسید قوی و باز قوی به $$pH$$ برابر با ۷ میانجامد. برای درک بهتر نحوه انجام این واکنش مثالی را مورد بررسی قرار میدهیم که در آن اسید $$HCl$$ و باز $$NaOH$$ است. در زیر واکنش بین این دو گونه را مشاهده میکنید.
$$ underset{acid}{HCl(aq)} + underset{base}{NaOH_{(aq)}} leftrightharpoons underset{salt}{NaCl_{(aq)}} + underset{water}{H_2O_{(l)}} $$
یکی از کارهای مفیدی که میتوانیم انجام دهیم، تفکیک هر اسید و باز به یونهای سازنده آن است. نحوه انجام این کار را در واکنش زیر مشاهده میکنید.
$$ {H^{+}(aq)} +{{Cl^{-}(aq)}} + {{Na^{+}(aq)}} + {OH^{-} (aq)} → {{Na^{+}(aq)}} + {{Cl^{-}_(aq)}} +{H_2O(l)} $$
به یونهایی که در هر دو سمت واکنش حضور دارند، «يون ناظر» (Spectator Ion) گفته میشود. زمانی که یونهای ناظر را از دو سمت واکنش حذف میکنیم، یون هیدروکسید و هیدرونیوم باقی میمانند که با یکدیگر تشکیل آب میدهند و آن را در زیر مشاهده میکنید.
$$ H^+_{(aq)} + OH^-_{(aq)} leftrightharpoons H_2O_{(l)} $$
در نقطه خنثی شدن این محلول دارای $$pH$$ برابر با ۷ است، یعنی مقدار $$OH^-$$ و $$H^+$$ در آن با یکدیگر برابری میکند. در این صورت مقدار مازادی از $$NaOH$$ و $$HCl$$ در محلول نداریم و رسوب $$NaCl$$ تشکیل میشود.
واکنش خنثی شدن اسید ضعیف و باز ضعیف
در صورتی که واکنش خنثی شدن بین یک اسید ضعیف و یک باز ضعیف انجام شود، با توجه به مقدار ثابت اسید و باز شرایط مختلفی میتواند به وجود بیاید که در زیر به آنها اشاره کردهایم.
- در صورتی که مقدار $$K_a$$ و $$K_b$$ با یکدیگر برابر باشد، مقدار $$pH$$ برابر با ۷ خواهد بود.
- در صورتی که مقدار $$K_a$$ بزرگتر از $$K_b$$ باشد، مقدار $$pH$$ کمتر از ۷ خواهد بود.
- در صورتی که مقدار $$K_a$$ کوچکتر از $$K_b$$ باشد، مقدار $$pH$$ بیشتر از با ۷ خواهد بود.
تیتراسیون اسید ها و باز ها
یکی از رایجترین روشهایی که طی آن واکنش خنثی شدن انجام میشود، استفاده از «تیتراسیون اسید و باز» (Acid and Base Titration) است. با توجه به اسید و باز مورد نظر شرایط تیتراسیون متفاوت خواهد بود. در ادامه نمونهای از یک تیتراسیون را مورد بررسی قرار میدهیم تا با این روش آشنایی بیشتری پیدا کنیم
در تیتراسیونی قرار است ۱۳ میلیلیتر از یک اسید ضعیف با مولاریته ۰٫۱ را با سدیم هیدروکسید ۰٫۱ مولار تیتر کنیم. هدف رسم نمودار تیتراسیون برای این مورد است.
برای این کار باید نقطه شروع منحنی را بیابیم بنابراین باید مقدار $$pH$$ اسید ضعیف را در ارلن، پیش از افزودن سدیم هیدروکسید به آن به دست آوریم. از همین جهت باید غلظت $$H_3O^+$$ را در این نقطه بیابیم.
$$ Ka=(7)(10^{-3}) $$
$$ K_a=(7)(10^{-3})=dfrac{(x^2)M}{(0.1-x)M} $$
$$ x=[H_3O^+]=0.023;M $$
در این صورت مقدار $$pH$$ این نقطه را به صورت زیر به دست میآوریم.
$$ pH=-log_{10}[H_3O^+]=-log_{10}(0.023)=1.64$$
توجه داشته باشید که برای رسم دقیق منحنی تیتراسیون، داشتن نقاط ابتدایی و انتهایی و نقطه همارزی کافی نیست و در صورت داشتن نقاط بیشتری منحنی دارای دقت بالاتری خواهد بود. بنابراین میخواهیم مشخصات نقطهای از تیتراسیون را به دست آوریم که در آن واکنش خنثی شدن ۵۰٪ پیشرفت داشته است.
برای این کار مقدار حجم مورد نیاز از باز برای رسیدن به نقطه همارزی را نصف میکنیم که برابر با ۶٫۵ مول میشود و از آن برای به دست آوردن تعداد مولهای اسید استفاده میکنیم.
$$ (6.5; mL)(0.1;M)= 0.65 ;mmol OH^- $$
$$ (10 ;mL)(0.1;M)= 1 ;mmol ;HX$$
برای به دست آوردن نقطهای که ۵۰٪ خنثی شدن صورت میگیرد میتوانم از «معادله هندرسون هاسلباخ» (Henderson Hasselbalch Equation) استفاده کنیم که آن را بهصورت زیر نمایش میدهند.
$$ pH=pK_a+log[frac{mmol ;Base}{mmol; Acid}] $$
$$ pH=pK_a+log[frac{0.65;mmol }{0.65;mmol}] $$
$$ pH=pK_a+log(1) $$
$$ pH=pK_a$$
بنابراین در زمانی که ۵۰٪ اسید ضعیف خنثی شده باشد، مقدار $$pH$$ با $$pK_a$$ برابر خواهد بود.

در مرحله بعد مقدار $$pH$$ را در نقطه همارزی به دست میآوریم. غلظت اسید ضعیف در زمان خنثی شدن نصف مقدار اصلی آن یعنی برابر با ۰٫۵ مولار است. برای به دست آوردن مقدار $$pH$$ از روش زیر استفاده میکنیم.
$$ Kb=(x^2)M/(0.05-x)M $$
در این مرحله میتوانیم عبارت $$K_b$$ را با $$ K_w/K_a $$ جایگزین کنیم. نتیجه آن را در زیر مشاهده میکنید.
$$K_w/K_a=(x^2)/(0.05)$$
$$x=[OH^-]=(2.67)(10^{-7})$$
$$pOH=-log_{10}((2.67)(10^{-7}))=6.57$$
$$pH=14-6.57=7.43$$
در مرحله بعد مقدار $$pH$$ را پس از نقطه همارزی به دست میآوریم. میدانیم که با افزودن ۱۳ میلیلیتر از سدیم هیدروکسید به نقطه همارزی میرسیم. حال نقطهای را در نظر میگیریم که ۱۴ میلیلیتر از آن افزوده شده باشد. محاسبات این مرحله بهصورت زیر خواهد بود.
$$ (14 :mL)(0.1:M)=1.4; mmol ;OH^- $$
$$ (10; mL)(0.1;M)= 1;mmol ;HX $$
$$ [OH^-]=frac{0.4;mmol}{10;mL+14;mL}=0.17;M $$
$$ pOH=-log_{10}(0.17)=1.8 $$
$$pH=14-1.8=12.2 $$
با توجه به اطلاعاتی که به دست آوردهایم، میتوانیم منحنی تیتراسیون این اسید و باز را به شکل زیر رسم کنیم.
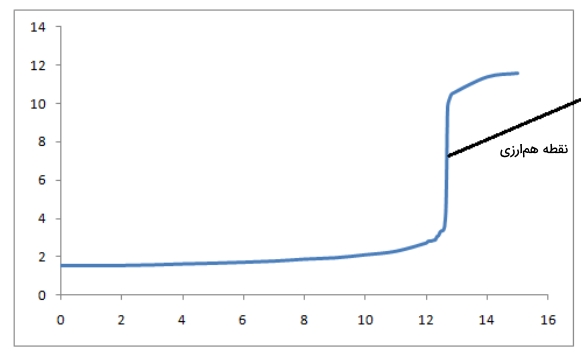
مثال از تیتراسیون
در تیتراسیونی اسید $$HCl$$ با مولاریته نامعلوم به عنوان آنالیت حضور دارد. ۵۰ میلیلیتر از آن را در یک بشر میریزیم و از سدیم هیدروکسید ۰٫۱ مولار به عنوان تیترانت بهره میبریم. نقطه پایانی این تیتراسیون در $$pH$$ برابر با ۷ است، بنابراین از لیتموس با مقدار $$pK_a$$ برابر با ۶٫۵ به عنوان شناساگر استفاده میشود. زمانی که ۱۰ میلیلیتر از سدیم هیدروکسید افزوده میشود، شاهد تغییر رنگ هستیم. مولاریته آنالیت را به دست آورید.
پاسخ
ابتدا واکنش موازنه شده این تیتراسیون را مینویسیم که بهصورت زیر است.
$$ HCl_{(aq)} + NaOH_{(aq)} rightarrow H_2O_{(l)} + Na^+ + Cl^- $$
در صورتی که یونهای ناظر را از دو سمت واکنش حذف کنیم، نتیجه به شکل زیر خواهد بود.
$$ H^+ + OH^- rightarrow H_2O_{(l)} $$
در ادامه برای محاسبه غلظت این جزء مجهول از رابطه زیر استفاده میکنیم.
$$ X= (0.1; M ;; NaOH) (10;mL) left(dfrac{1;L}{1000; mL} right) left( dfrac{1;mol; NaOH}{1; mol ; OH^-} right) $$
$$ H^+ = X ;; HCl $$
$$X = 0.0010 ;mol ;of; HCl$$
$$ dfrac{0.0010; mol; HCl}{0.050; L} = 0.020;M ;HCl $$
بنابراین آنالیت این تیتراسیون دارای مولاریته برابر با ۰٫۰۲ است.
واکنش اسید ها و باز ها
انواع واکنش اسید و باز وجود دارند که در این بخش میخواهیم به برخی از این واکنشها بپردازیم و آنها را مرور کنیم.
واکنش اسید ها و باز ها با فلزها
زمانی که یک فلز با اسید وارد واکنش میشود، بهطور معمول جایگزین هیدروژن در اسید خواهد شد و در نتیجه گاز هیدروژن تشکیل شده از محیط خارج میشود. فلز با بخش باقی مانده اسید واکنش میدهد و یک نمک به وجود میآید. برای مثال به واکنش زیر توجه کنید که مربوط به اسید سولفوریک و فلز روی است.
$$ begin{array}{l}H_2SO_4 ~+~ Zn ~rightarrow ~ZnSO_4 ~+ ~H_2end{array} $$
بازهایی که در آب محلول هستند نیز با فلزها وارد واکنش میشود و با تصاعد گاز هیدروژن، یک نمک را به وجود میآورند. برای مثال به واکنش سدیم هیدروکسید و روی توجه کنید.
$$ begin{array}{l}2~ NaOH~ +~ Zn ~rightarrow~ Na_2ZnO_2 ~+~ H_2end{array} $$
واکنش اسید با اکسید فلز
اکسید فلزها با اسیدها وارد واکنش میشوند و محصولات نمک و آب را تولید میکنند. برای مثال به واکنش زیر که مربوط به مس اکسید و هیدروکلریک است، توجه کنید.
$$ begin{array}{l}CuO~ + ~2HCl ~rightarrow~ CuCl_2 ~+~ H_2end{array} $$
واکنش اسیدها با کربنات فلز و بیکربنات فلز
کربناتها و بیکربناتهای فلزی با اسیدها وارد واکنش میشوند و سه محصول نمک، کربن دیاکسید و آب را به وجود میآورند. برای مثال به واکنش زیر توجه کنید. در این واکنش $$Na_2CO_3$$ با $$HCl$$ وارد واکنش میشود و نمک سدیم کلرید را به جود میآورد.
$$begin{array}{l}Na_2CO_3~ + ~HCl~ (aq)~rightarrow ~2NaCl ~(aq)~ +~ H_2O (l)~ +~ CO_2end{array} $$
واکنش اکسیدهای نافلز با بازها
واکنش دیگری که بازها در آن شرکت میکنند، واکنش با اکسیدهای نافلزی است که طی آن دو ماده آب و نمک تولید میشود. برای نمونه در واکنش زیر کربن دیاکسید با کلسیم هیدروکسید وارد واکنش شده است.
$$ begin{array}{l}CO_2 ~+ ~Ca~ (OH)_2~ rightarrow~ CaCO_3 ~+ ~H_2Oend{array} $$
ویژگیهای اسید ها و باز ها
حال که با اسید ها و باز ها آشنا شدیم، میخواهیم بدانیم ترکیبات این خانواده گسترده چه ویژگیهایی از خود به نمایش میگذارند. در فهرست زیر به تعدادی از آنها اشاره کردهایم.
- اسیدها طعمی ترش دارند اما بازها تلخ هستند.
- اسیدها در آب حل میشوند اما این در مورد تمامی بازها صدق نمیکند.
- بازها ترکیبات بیرنگی هستند اما هیدروکسیدهای آهن و مس استثنا به شمار میروند.
- اسیدهای معدنی مایعاتی بیرنگ هستند اما در برخی مواقع اسید سولفوریک از خود رنگ زردی به نمایش میگذارد که به دلیل ناخالصیهای موجود در آن است. برخی از اسیدهای آلی مانند بنزوئیک اسید نیز جامداتی به رنگ سفید هستند.

- مقدار $$pH$$ اسیدها زیر ۷ است اما بازها دارای $$pH$$ بیش از ۷ هستند.
- کاغذ لیتموس در اسیدها به رنگ قرمز و در بازها به رنگ آبی درمیآید.
- اسید ها و باز ها در آب هادی الکتریسیته هستند.
- سرکه و لیمو ترش ترکیبات طبیعی دارای اسید هستند. از بازها میتوان به جوش شیرین اشار کرد.
آمفوتر چیست؟
بسیاری از مولکولها و یونها مانند آب میتوانند تحت شرایط مناسب هم پروتون از دست بدهند، هم آن را دریافت کنند. به چنین گونههایی «ترکیبات آمفوتر» (Amphoter Species) گفته میشود. برای مثال به یون کربنات توجه کنید که در یکی از واکنشهای زیر اسید و در دیگری نقش باز را ایفا میکند.
$$ {HCO^-_3(aq) + H_2O(l) rightleftharpoons CO^{2-}_3(aq) + H_3O^+(aq)} nonumber $$
$$ {HCO^{-}_3(aq) + H_2O(l) rightleftharpoons H_2CO_3(aq) + OH^{-}(aq)} nonumber $$
مثال و حل تمرین
حال که با انواع اسید ها و باز ها آشنا شویم و جزئیات مربوط به هر کدام را مورد بررسی قرار دادیم، میخواهم در این بخش ابتدا تعدادی مثال را به همراه پاسخ تشریحی مرور کنیم و سپس تعدادی تمرین چندگزینهای را پاسخ میدهیم.
مثال
در این بخش تعدادی مثال را پیرامون اسید ها و باز ها بررسی میکنیم و در هر مورد پاسخ تشریحی آنها را نیز میآوریم. با توجه به این پاسخهای تشریحی میتوان به پرسشهای مشابه پاسخ داد.
مثال اول
معادله شمیایی موازنه شده مربوط به تفکیک $$Ca(OH)_2$$ را بنویسید و مشخص کنید که آیا پیشروی ۱۰۰٪ دارد یا خیر؟
پاسخ
این ترکیب یک ترکیب یونی است و از دو یون $$Ca^{2+}$$ و $$OH$$ به وجود میآيد. زمانی که یک ترکیب یونی در آب حل میشود، به یونهای سازنده خود تفکیک میشود و میتوان آن را بهصورت زیر نمایش داد.
$$ {Ca(OH)_2 → Ca^{2+}(aq) + 2OH^{−}(aq)} nonumber $$
این واکنش پیشروی ۱۰۰٪ خواهد داشت زیرا بازی داری هیدروکسید است.
مثال دوم
با توجه به واکنش تعادلی زیر بگویید کدام یک از گونههای شرکتکننده در آن نقش اسید برونستد لوری را ایفا میکنند؟
$$ mathrm{NH}_3+mathrm{H}_2 mathrm{O} rightleftharpoons mathrm{NH}_4^{+}+mathrm{OH}^{-} $$
پاسخ
میدانیم که اسید برونستد لوری گونهای است که به گونه دیگر پروتون میدهد. در واکنش رفت آب یک یون هیدرونیوم به آمونیاک داده است و خود تبدیل به $$OH^-$$ شده است. همچنین در واکنش برگشت گونه آمونیوم با فرمول $$NH_4^+$$ یک هیدرونیوم از دست میدهد. بنابراین هر دو این گونهها در نقش اسید برونستد لوری عمل میکنند.
مثال سوم
مقدار $$K_b$$ و $$pK_b$$ را برای یون بوتیرات با فرمول شیمیایی $$CH_3CH_2CH_2CO_2^-$$ بیابید. مقدار $$pK_a$$ بوتیریک اسید در دمای ۲۵ درجه سانتیگراد برابر با ۴٫۸۲ است.
پاسخ
در صورت این سوال مقدار $$pK_a$$ بوتیریک اسید داده شده است و باید مقدار $$K_b$$ و $$pK_b$$ مربوط به باز مزدوج آن یعنی یون بوتیرات را به دست آوریم. از آنجا که دمای اندازهگیری برابر با ۲۵ درجه سانتیگراد است میتوانیم از رابطه زیر برای رسیدن به پاسخ استفاده کنیم.
$$ pK_a + pK_b = pK_w =14$$
با جایگزین کردن مقدار $$pK_b$$ خواهیم داشت:
$$ 4.83+pK_b=14.00 nonumber $$
$$pK_b=14.00−4.83=9.17 nonumber $$
با توجه به رابطه زیر مقدار $$K_b$$ برابر با $$ 6.8times10^{-10}$$ خواهد بود.
$$ pK_b = −log K_b $$
مثال چهارم
به توجه به واکنش زیر بگویید نمک تولید شده طی آن در چه محدوده $$pH$$ قرار دارد؟
$$ CH_3COOH_{(aq)} + NaOH_{(s)} leftrightharpoons Na^+ + CH_3COO^- + H_2O_{(l)} $$
پاسخ
در صورتی که یونهای ناظر موجود در این واکنش را از دو طرف حذف کنیم، نتیجه بهصورت زیر خواهد بود.
$$ CH_3CO_2H_{(aq)} + OH^- leftrightharpoons CH_3COO^- + H_2O_{(l)} $$
در این صورت میتوان اینطور جمعبندی کرد که در این واکنش خنثی شدن یک اسید ضعیف با فرمول شیمیایی $$CH_3COOH$$ f به وسیله باز قوی $$OH^-$$ خنثی شده است که تحت چنین شرایطی مقدار $$pH$$ بیشتر از ۷ خواهد بود.
مثال پنجم
برای تیتراسیون ۴۵ میلی لیتر از $$HNO_3$$ با مولاریته ۰٫۰۴۵۲ به چه مقدار از $$Ba(OH)_2$$ با مولاریته ۰٫۹۵۵ نیاز داریم؟
پاسخ
برای پاسخ به مسائل مربوط به تیتراسیون میتوانیم از رابطه زیر استفاده کنیم.
$$ M_1V_1= M_2V_2 $$
تمامی مولفههای این رابطه به جز حجم باریم هیدروکسید را در دست داریم. با جایگذاری مقادیر، مجهول به صورت زیر به دست میآيد.
$$ V_2= dfrac{M_1V_1}{M_2} = dfrac{(0.0452)(0.045)}{0.0955} = 21.2; mL $$
بنابراین برای تیتراسیون ۴۵ میلیلیتر $$HNO_3$$ به ۲۱٫۲ میلیلیتر از باریم هیدروکسید نیاز داریم.
مثال ششم
مقدار $$pH$$ نمکی که طی واکنش زیر به دست میآید، برابر با چه مقداری است؟
پاسخ
میدانیم که سدیم هیدروکسید باز قوی است و $$H_2SO_4$$ نیز اسید قوی به شمار میرود. بنابراین محصول این واکنش خنثی است و مقدار $$pH$$ آن برابر با ۷ خواهد بود.
مثال هفتم
تفاوت اسید و باز مزدوج در چیست؟
پاسخ
زوج اسید و باز تنها در یک عدد پروتون با یکدیگر متفاوت هستند. برای مثال میتوان به باز $$NH_3$$ و اسید $$NH_4^+$$ اشاره کرد.
مثال هشتم
در هر یک از واکنشهای زیر کدام گونه اسید لوییس و کدام گونه باز لوییس به شمار میرود؟
واکنش اول
$$ (CH_3)_2O + BF_3 → (CH_3)_2O:BF_3 $$
در این واکنش گونه $$(CH_3)_2O$$ نقش اسید لوییس و گونه $$BF_3$$ نقش باز لوییس را ایفا میکند.
واکنش دوم
$$ H_2O + SO_3 → H_2SO_4 $$
آب در این واکنش نقش باز لوییس را ایفا میکند. همچنین $$SO_3$$ اسید لوییس است.
مثال نهم
واکنشی طراحی کنید که در آن گونه $$H_2PO_4^-$$ نقش اسید را با گونه $$HBr$$ ایفا کند.
پاسخ
$$ {H_2PO_4^-}(aq)+{HBr}(aq)rightleftharpoons {H_3PO_4}(aq)+{Br^-}(aq) $$
مثال دهم
واکنشی طراحی کنید که در آن گونه $$H_2PO_4^-$$ نقش باز را با گونه $$OH^-$$ ایفا کند.
پاسخ
$$ {H_2PO_4^-}(aq)+{OH^-} (aq)rightleftharpoons {HPO_4^{2-}}(aq)+ {H_2O}_{(l)} $$
مثال یازدهم
واکنشی بنویسید که در آن گونه $$HSO_3^-$$ نقش اسید را در برابر هیدروکسید ایفا کند.
پاسخ
$$ {HSO_3^-}(aq)+ {OH^-}(aq)rightleftharpoons {SO_3^{2-}}(aq)+ {H_2O}_{(l)} $$
تمرین
حال که تعدادی مثال را بررسی کردیم، به تمرینهای چندگزینهای پیرامون اسید ها و باز ها میپردازیم.
تمرین اول
کدام یک از گزینههای زیر در مورد گونه شیمیایی $$C_5H_5N$$ صدق میکند؟
این مولکول باز ضعیف است.
این مولکول اسید ضعیف است.
این مولکول باز قوی است.
این مولکول اسید قوی است.
تمرین دوم
کدام یک از گزینههای زیر دو گونه $$RbOH$$ و $$HNO_2$$ را بهتر توصیف میکنند؟
$$RbOH$$ باز قوی و $$HNO_2$$ اسید ضعیف است.
$$RbOH$$ باز ضعیف و $$HNO_2$$ اسید ضعیف است.
$$RbOH$$ اسید قوی و $$HNO_2$$ باز قوی است.
$$RbOH$$ باز ضعیف و $$HNO_2$$ اسید قوی است.
تمرین سوم
کدام یک از گونههای شیمیایی زیر مربوط به یک اسید قوی است؟
تمرین چهارم
کدام یک از گزینههای زیر با توجه به نظریه اسید ها و باز ها برونستد لوری، یک باز به شمار میرود؟
تمرین پنجم
کدام یک از گزینههای زیر باز برونستد لوری است اما نمیتواند باز آرنیوس باشد؟
در نظریه اسید ها و باز ها برونستد لوری، گونهای که بتواند یون هیدرونیوم دریافت کند، باز به حساب میآید. همچنین در گزینههای بالا، $$NaOH$$ و $$Ca(OH)_2$$ و $$KOH$$ همگی باز آرنیوس هستند زیرا میتوانند دستخوش یونیزاسیون شوند و یون هیدروکسید را به وجود آورند اما $$NH_3$$ تفکیکی مانند بقیه نخواهد داشت.
آمونیاک زمانی که در آب حل میشود، یک پروتون از آب دریافت میکند و خود تبدیل به $$NH_4^+$$ میشود در حالی که از آب تنها یون هیدروکسید باقی میماند. بنابراین پاسخ صحیح آمونیاک است.
تمرین ششم
لاکتیک اسید با فرمول شیمیایی $$ CH_3CH(OH)CO_2H $$ مسئول ایجاد بو و طعم ناخوشایند در شیر فاسد است. مقدار $$pK_a$$ آن در دمای ۲۵ درجه سانتیگراد برابر با ۳٫۸۶ است. در این صورت مقادیر $$K_2$$ و $$K_b$$ آن به ترتیب در کدام گزینه بهصورت صحیح آورده شده است؟
$$ K_a = 1.4 times 10^{−4} $$ و $$ K_b = 7.2 times 10^{−11} $$
$$ K_a = 1.4 times 10^{−4} $$ و $$ K_b = 7.2 times 10^{−1} $$
$$ K_a = 1.4 times 10^{−3} $$ و $$ K_b = 7.2 times 10^{−10} $$
$$ K_a = 1 times 10^{−4} $$ و $$ K_b = 7.2 times 10^{−11} $$
تمرین هفتم
مقدار ثابت تعادل بازی دیمتیل آمین با فرمول شیمیایی $$(CH_3)_2NH$$ در دمای ۲۵ درجه سانتیگراد برابر با $$ 5.4times10^{-4}$$ است. مقدار $$K_a$$ و $$pK_a$$ برای یون دیمتیل آمونیوم در کدام گزینه بهصورت صحیح آورده شده است؟
$$ K_a=1.9 times 10^{−1} nonumber $$ و $$ pK_a=10.73 nonumber $$
$$ K_a=1.9 times 10^{−11} nonumber $$ و $$ pK_a=10.35 nonumber $$
$$ K_a=1 times 10^{−11} nonumber $$ و $$ pK_a=11 nonumber $$
$$ K_a=1.9 times 10^{−11} nonumber $$ و $$ pK_a=10.73 nonumber $$
تمرین هشتم
میدانیم که در تیتراسیون ۲۵ میلیلیتر از محلول پتاسیم هیدروکسید با مولاریته ۰٫۱۳۵، به ۳۱ میلیلیتر از یک محلول اسیدی نیاز است. غلظت این اسید نشناخته در کدام یک از گزینههای زیر بهصورت صحیح آورده شده است؟
تمرین نهم
کدام یک از گزینههای زیر نمونهای از یک اسید نیست؟
تمرین دهم
اسید ها و باز ها قوی ترکیباتی هستند که …
مقدار $$pH$$ بالایی دارند.
یونیزه نمیشوند.
بهطور کامل در محلول یونیزه میشوند.
تمرین یازدهم
کدام یک از گزینههای زیر یک اسید لوییس نیست؟
آلومینیو کلرید
گوگرد تترا فلوئورید
یون هیدروکسید
تمرین دوازدهم
در کدام یک از گزینههای زیر دو گونه داده شده اسید و باز مزدوج نیستند؟
$$HPO_3^{2-}$$ و $$PO_3^{3-}$$
$$H_2PO_4^-$$ و $$HPO_4^{2-}$$
$$H_2PO_4^-$$ و $$H_3PO_4$$
$$H_2PO_4^-$$ و $$PO_3^{3-}$$
تمرین سیزدهم
کدام یک از گونههای زیر میتواند هم اسید مزدوج، هم باز مزدوج به شمار آید؟
تمرین چهاردهم
اسید مزدوج یون $$O^{2-}$$ در کدام یک از گزینههای زیر بهصورت صحیح آورده شده است؟
تمرین پانزدهم
گاز آمونیاک در آب حل میشود و گونه $$NH_4OH$$ را به وجود میآورد. در این واکنش، آب نقش … را ایفا میکند.
سوالات متداول
حال که با انواع اسید ها و باز ها و ویژگیهای آنها آشنا شدیم، میخواهیم در این بخش به تعدادی از مهمترین و پرتکرارترین پرسشهای موجود پیرامون آنها پاسخ دهیم.
اسید ها و باز ها طبق نظریه برونستد لوری چیستند؟
اسید برونستد لوری گونهای است که بهصورت مستقیم با غیرمستقیم پروتون بدهد و باز آن گونهای است که بهصورت مستقیم یا غیرمستقیم پروتون بگیرد.
آمفوتر چیست؟
بسیاری از مولکولها و یونها مانند آب میتوانند تحت شرایط مناسب هم پروتون از دست بدهند، هم آن را دریافت کنند. به چنین ترکیباتی آمفوتر گفته میشود.
تفاوت باز قوی با باز ضعیف چیست؟
باز قوی بازی است که در محلول بهصورت کامل و ۱۰۰٪ تفکیک شود، در صورتی که تفکیک اسیدی کمتر از ۱۰۰٪ باشد، آن را به عنوان باز ضعیف میشناسیم.
اسید ها و باز ها طبق نظریه لوییس چیستند؟
با توجه به نظریه لوییس، اسید لوییس گونه گیرنده الکترون و باز اسید گونه دهنده الکترون است.
واکنش خنثی شدن اسید ها و باز ها چیست؟
واکنش خنثی شدن زمانی انجام میشود که یک اسید و یک باز با یکدیگر وارد واکنش شوند و دو محصول آب و نمک را به وجود بیاورند
جمعبندی
هدف از این مطلب مجله فرادرس آشنایی با انواع اسید ها و باز ها در شیمی بود. ابتدا به معرفی سه نظریه آرنیوس، برونستد لوری و لوییس پرداختیم که از آنها برای شناسایی ترکیبات اسیدی و بازی استفاده میشود. سپس اسید ها و باز ها قوی و ضعیف و مزدوج را بررسی کردیم. در ادامه با مولفه ثابت تعادل برای اندازهگیری قدرت این دسته از ترکیبات آنشا شدیم که در حل مسائل مورد نیاز است. سپس ویژگیهایی که اسید ها و باز ها از خود نشان میدهند را معرفی کردیم و در نهایت تعدادی مثال و تمرین را مرور کردیم.
source